 咨询热线:
咨询热线:疫情在全球范围内的大流行使得口罩等防疫物资成为一季度出口的爆单产品。
韩国、伊朗、土耳其、法国、马来西亚、泰国、越南、吉尔吉斯斯坦、巴基斯坦、斯里兰卡、马尔代夫、巴西、委内瑞拉、津巴布韦、欧亚经济联盟等国家或地区均给予相关产品关税减免或通关便利。
毕竟,当前“一罩难求”的紧急情况下,只有逐渐摆脱疫情、恢复生产的中国有能力满足如此庞大的医疗物资需求。
但目前口罩等防疫物资出口有了新的变化。
01
美国拒批进口中国KN95口罩
3月17日,美国疾病控制与预防中心(CDC)发布了《优化N95口罩供应策略:危机/替代策略》,指出新冠肺炎疫情期间,当N95口罩供给不足时,按巴西、韩国、日本、澳大利亚、欧盟、墨西哥、中国标准生产的口罩是N95口罩合适的替代品,其中包括采用中国标准GB 2626-2006、GB/T 18664-2002生产的KN100、KP100、KN95、KP95口罩。
但就在美国确诊人数疯狂上涨的情况下,3月28日,美国FDA又发布了一份面向未达NIOSH标准的进口一次性过滤口罩制造商、卫生保健人员、医院采购部门和分销商、进口商和商业批发商的“紧急使用管理”信函(Emergency-Use-Administration, 简称EUA),修改了授权范围。
根据新的授权范围,只有澳大利亚、巴西、欧盟、日本、韩国、墨西哥这六个国家和地区满足要求,中国被剔除在外。
这就意味着,上述六个国家和地区的口罩,如果满足自己国家或地区的相关标准并取得了相关认证,可以出口美国,但中国标准的KN95等口罩却不行,必须达到NOISH标准和认证才能在美国医疗机构使用。
美方公告:www.fda.gov/media/136403/download
截至北京时间4月1日早晨,美国共报告新冠肺炎确诊病例186265例,确诊数居全球首位。
“当美国各地的医院拼命寻找N95口罩来保护医护人员治疗新冠肺炎患者时,美国联邦政府已禁止进口可能是世界上最丰富的替代品。”美版今日头条BuzzFeed的报道称,“如果没有FDA的批准,进口商会犹豫订购KN95口罩,因为他们担心会被海关扣押。许多医院都拒绝接受这些捐赠,即使是免费的,因为他们担心如果医护人员在使用未经许可的设备时生病,将会承担法律责任。”
美国进口商鲍勃·蒂尔顿说,“现在更容易买到KN95口罩,N95很难买到。但我不想为运送口罩而冒险损失50万或100万美元。”
而美国总统特朗普则呼吁,美国民众“可以戴围巾”来替代口罩。
02
加拿大将评估中国产医疗物资
加拿大政府在接收从中国来的救援设备后,停止把设备分发给各大医院。加拿大卫生部在致加拿大新闻社的一份声明中说:“这批货物的一部分已经交付给相关医疗服务机构。这批货物的‘口罩部分’则被搁置,没有进一步分发,接受评估。”
3月29日,加拿大总理贾斯汀·特鲁多在新闻发布会上承诺,在确保中国提供的口罩符合质量标准以前,联邦卫生当局将不再分发救援设备,并不遗余力的调查这批口罩的质量问题。
特鲁多说:“我可以向人们保证,加拿大卫生部有很严格的程序来评估我们接获的物资符合必要的标准,并且不会有任何捷径。”“我们需要确保医护人员所依赖的用品和设备是安全的,确保他们能够完成工作的质量,确保他们的安全。”
03
荷兰、西班牙发现产品质量问题
3月28日荷兰卫生部发表声明指,21日收到130万个标明“KN95”等级的中国制口罩,但当局经两次测试,发现口罩未能紧贴脸部及过滤病毒功能不合格。而首批60万只口罩已分发到各地医院供医护使用。当局紧急下令全部收回,并将更严格地检测从中国订购的口罩。
而据西班牙媒体《国家报》、《世界报》等媒体报道,西班牙从中国采购的一批新冠病毒快速检测试剂盒结果不精确,按要求试剂盒的精确度应超过80%,但这批试剂盒仅为30%。
对此,中国驻西班牙大使馆回应称,试剂盒提供方为深圳一家企业,并不在中国商务部已向西班牙提供的医疗设备销售企业名单中,且尚未获得中国国家药品监督管理局的销售许可。

西班牙政府则在随后的一份声明中表示,这批涉事次品试剂盒并非由西班牙政府直接从中国政府采购,而是通过一家本国供应商从中国生产商处进口。西班牙已立即退回这批试剂盒,并联系供应商要求用其他试剂盒来替代。
深圳的这家企业则发布申明解释:经了解,在采样和样本提取过程中,可能没有严格按照其操作使用说明来进行鼻咽拭子样本的采样、提取和操作,因此导致样本检测准确度下降。
目前深圳市市场监督管理局已启动快速核查,具体情况将持续通报。
04
4月起医疗物资出口需声明
3月31日晚,商务部、海关总署、国家药品监督管理局紧急发布了一则通知——《关于有序开展医疗物资出口的公告》(2020年第5号)。
公告称:
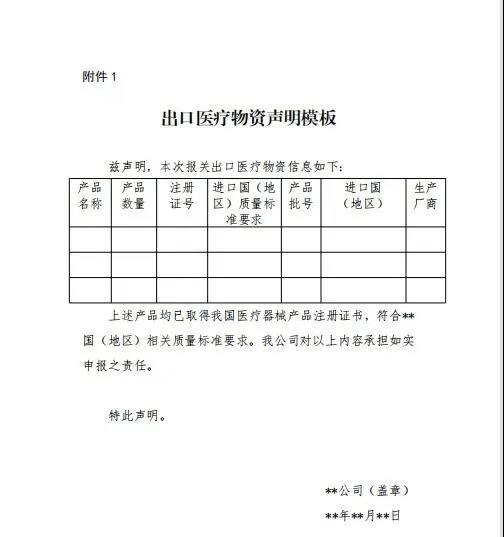
“自4月1日起,出口新型冠状病毒检测试剂、医用口罩、医用防护服、呼吸机、红外体温计的企业向海关报关时,须提供书面或电子声明(模版见附件1),承诺出口产品已取得我国医疗器械产品注册证书(相关注册信息见附件2),符合进口国(地区)的质量标准要求。海关凭药品监督管理部门批准的医疗器械产品注册证书验放。上述医疗物资出口质量监管措施将视疫情发展情况动态调整。”
公告地址:http://www.mofcom.gov.cn/article/b/c/202003/20200302950371.shtml?from=groupmessage&isappinstalled=0
可在此下载《出口医疗物资声明模板》和《我国相关医疗器械产品注册信息(国家药监局网站www.nmpa.gov.cn动态更新)》。
此外,3月31日下午,国家药监局药品监管司召开了2020年药品上市后监管工作重点任务部署视频会议。会议内容值得大家引起注意!
会议强调,要妥善做好出口药品质量监管, 严格规范药品出口证明管理,对不符合出证条件和要求、未遵守我国药品GMP等情形,坚决依法撤销其药品出口证明;要继续加强药品生产监管,切实保证出口药品质量符合要求;要加强与市场监管、海关、公安等部门协同,严厉打击违法违规行为。
会议要求,各级药监部门要加大违法案件查办力度,按照“四个最严”要求,严肃查处违法违规行为。要根据实际情况充分运用财产罚、资格罚、自由罚、声誉罚等手段,切实处罚到企业、处罚到人;还要充分运用告诫、约谈、限期整改等措施,对存在质量问题或者其他安全隐患的,依据风险采取暂停生产、销售、使用、进口等相应控制措施,及时控制风险。各地要强化与市场监管综合执法机构的协同,加快建立监管与稽查有效衔接机制;深化与公安机关沟通协调,强化行刑衔接,形成案件查办合力。针对问题风险易发多发的环节或领域,国家药监局将部署集中开展专项整治,通过整治进一步规范生产经营行为,对发现的违法违规行为严肃查处并公开曝光,形成强大震慑效应。
05
警惕医疗器械产品出口风险
请外贸人务必注意近期医疗器械产品出口的法律风险,供货紧缺并不等于买家能接受不合格产品,切勿因为市场火爆而盲目入行。
建议出口方:
1. 了解各个出口市场的医疗器械产品准入标准,以及认证情况,并对这些信息保持更新。
2. 重视认证的真实有效,严格审查代理中介的资质,不要选择那些报价显著低于正常价格的代理,要知道,无良代理签发出无效认证,最后倒霉的可是出口商!
3. 严格按照标准进行生产,保证自身产品合法合规。
4. 退潮方知裸泳者,建议谨慎看待这一波“口罩红利期”。


提升品牌全球影响力
多语种营销策略定制
分析竞争对手营销策略,获取更多自然流量
专业的独立站建设与优化
有效的谷歌、Yandex搜索引擎广告服务
持续的社交媒体运营与推广
高质量软文撰写、外链发布
